Тема 9:
ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ
Просте формулювання першого закону термодинаміки може звучати приблизно так: зміна внутрішньої енергії тієї чи іншої системи можливо виключно при зовнішньому впливі. Тобто іншими словами, щоб в системі відбулися якісь зміни необхідно докласти певних зусиль ззовні. У народній мудрості своєрідним вираженням першого закону термодинаміки можуть служити прислів’я – «під лежачий камінь вода не тече», «без праці не витягнеш рибку зі ставка», тощо. Тобто на прикладі прислів’я про рибку і працю, можна уявити, що рибка і є наша умовно закрита система, в ній не відбудеться ніяких змін (рибка сама себе не витягне зі ставка) без нашого зовнішнього впливу та участі (праці).
Цікавий факт: саме перший закон термодинаміки встановлює, чому зазнали невдачі всі численні спроби вчених, дослідників, винахідників винайти «вічний двигун», адже його існування є абсолютно неможливим згідно з цим самим законом, чому, дивіться абзац вище.
На початку нашої статті було максимального просте визначення першого закону термодинаміки, в дійсності в академічній науці існує цілих чотири формулювання суті даного закону:
- Енергія нізвідки не з’являється і ні куди не пропадає, вона лише переходить з одного виду в інший (закон збереження енергії).
- Кількість теплоти, отриманої системою, йде на здійснення її роботи проти зовнішніх сил і зміну внутрішньої енергії.
- Зміна внутрішньої енергії системи при переході її з одного стану в інший дорівнює сумі роботи зовнішніх сил і кількості теплоти, переданої системі, і не залежить від способу, яким здійснюється цей перехід.
- Зміна внутрішньої енергії неізольованою термодинамічною системою дорівнює різниці між кількістю теплоти, переданої системі, і роботою, досконалої системою над зовнішніми силами.
Формулу першого закону термодинаміки можна записати таким чином:
Q = ΔU + A
Кількість теплоти Q, що передається системі дорівнює сумі зміни її внутрішньої енергії ΔU і роботи A.
Також перший закон термодинаміки має свої нюанси залежно від наявних термодинамічних процесів, які можуть бути ізохронними і ізобарними, і нижче ми детально опишемо кожний з них.
Ізохорним процесом в термодинаміці називають процес, що відбувається при постійному об’ємі. Тобто, якщо будь-якому в газі або рідині нагріти речовину в посудині, відбудеться ізохорний процес, так як обсяг речовини залишиться незмінним. Ця умова має вплив і на перший закон термодинаміки, що проходить при ізохорному процесі.
У ізохорному процесі об’єм V є константою, отже, газ роботи не робить A = 0
З цього виходить наступна формула:
Q = ΔU = U (T2) – U (T1).
Тут U (T1) і U (T2) – внутрішні енергії газу в початковому і кінцевому станах. Внутрішня енергія ідеального газу залежить тільки від температури (закон Джоуля). При ізохорному нагріванні тепло поглинається газом (Q> 0), і його внутрішня енергія збільшується. При охолодженні тепло віддається зовнішнім тілам (Q <0).
Аналогічно ізобарним процесом називається термодинамічний процес, що відбувається в системі при постійному тиску і масі газу. Отже, в ізобарному процесі (p = const) робота, що здійснюються газом, виражається наступним рівнянням першого закону термодинаміки:
A = p (V2 – V1) = p ΔV.
Ізобарний перший закон термодинаміки дає:
Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV.
При ізобарному розширенні Q>0 – тепло поглинається газом, і газ здійснює позитивну роботу. При ізобарному стисненні Q
Перший закон термодинаміки має практичне застосування до різних процесів у фізиці, наприклад, дозволяє обчислити ідеальні параметри газу при різноманітних теплових і механічних процесах. Крім суто практичного застосування можна цьому закону знайти застосування і філософське адже що не кажіть, але перший закон термодинаміки є виразом одного з найбільш загальних законів природи – закону збереження енергії. Ще Еклезіаст писав, що ніщо нізвідки не з’являється і нікуди не йде, все перебуває вічно, постійно трансформуючись, в цьому і криється вся суть першого закону термодинаміки.
Натисніть на посилання.https://www.youtube.com/watch?v=mPlAFxlaL0I
Тема 10: Закони термохімії
Розділ хімічної термодинаміки, що вивчає теплові ефекти реакцій, називається термохімією. Якщо теплота підводиться до системи (QТ 0), реакцію називають ендотермічною, якщо ж теплота виділяється в навколишнє середовище (QТ 0), реакцію називають екзотермічною.
Термохімічні рівняння реакцій
- коли теплота реакції вказується в правій частині термохімічного рівняння, наприклад, С6Н6(р)+7
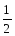 О2 = 6СО2+3Н2О(р)+3267,7 кДж; тоді при Q 0 – екзотермічна реакція; при Q 0 – ендотермічна реакція;
О2 = 6СО2+3Н2О(р)+3267,7 кДж; тоді при Q 0 – екзотермічна реакція; при Q 0 – ендотермічна реакція; - коли тепловий ефект реакції записують у вигляді зміни ентальпії Н, наприклад, 2С6Н6(р)+15О2 = 12СО2+6Н2О(р) Н = –6535,4 кДж; тоді при Н 0 – реакція екзотермічна; при Н 0 – реакція ендотермічна.
Щоб тепловий ефект реакції був віднесений до кількості 1 моль однієї з вихідних речовин або продуктів реакції, в термохімічних рівняннях допускається використання дробових коефіцієнтів. Ентальпією (теплотою) утворення хімічної сполуки НТ називається зміна ентальпії в процесі одержання одного моля цієї сполуки з простих речовин, стійких при даній температурі.
Стандартний стан речовини
Стандартним станом розчиненої речовини при даній температурі буде його стан, що відповідає концентрації 1 моль/л, при умові, що розчин має властивості, якими він володів би при тій же температурі і нескінчено великому розведенні.
Стандартною ентальпією (теплотою) утворення хімічної сполуки називають зміну ентальпії в процесі утворення одного моля цієї сполуки з простих речовин, що знаходяться в стандартних станах і термодинамічно стійкі при даній температурі. Стандартні ентальпії утворення простих речовин приймають рівними нулю.
Термохімічні розрахунки
Так, для реакції aА+bB = cC+dD Н = (cНутв.(С) +dНутв.(D))–(аНутв.(А)+bНутв.(В))
Комментарии
Отправить комментарий