Тести
Натисніть на посилання.
або
Натисніть на посилання.
https://naurok.com.ua/test/join?gamecode=470722
Зареєструйтися: введіть своє призвище, імя.
Тести необхідно пройти до 10 травня 17:00.
Зареєструйтися: введіть своє призвище, імя.
Тести необхідно пройти до 10 травня 17:00.
Тема 8: Основні поняття термодинаміки
Термодинаміка вивчає закони взаємного перетворення теплоти і механічної роботи, а також досліджує найбільш ефективні умови та напрям таких перетворень.
Робочими тілами (РТ)для перетворення теплоти в роботу є гази й пари. Процеси перетворення різних видів енергії приводять до зміни стану та параметрів робочих тіл і проходження термодинамічних процесів.
Найбільш загальні, універсальні закони термодинаміки виведені для ідеального газу– умовного ідеального робочого тіла, об’ємом молекул і силами взаємодії яких нехтують, що не можна робити для реальних газів та парів. При розрахунках реальних робочих тіл необхідно враховувати їх відмінності від ідеальних газів, що можуть бути суттєвими, особливо при високому тиску, низькій температурі РТ, виконанні розрахунків, пов’язаних із комерційним обліком чи визначенням параметрів безпечної експлуатації обладнання. Закони ідеальних газів із достатньою точністю можуть бути використані для реальних газів після введення відповідних поправок.
До термодинамічних параметрівстану робочого тіла належать:
– температура Т, ºК;
– тиск РА, Па;
– питомий об’єм υ, м3/кг.
Температура характеризує тепловий стан робочого тіла. Якщо температури двох ідеальних газів однакові, то між ними не відбувається самовільний процес теплообміну, а самі робочі тіла знаходяться у стані теплової рівноваги.
Існують такі шкали вимірювання температур:
–шкала Цельсія t 0С;за 00С у якій прийнято вважати температуру переходу води в кристалічний стан за нормальних умов (НУ), а за 1000С – стан кипіння тієї ж самої води за НУ;
– шкала Кельвіна T 0K, у якій за 00K прийнятий стан, що називаютьабсолютним нулем,– температура, при котрій у будь-якому тілі припиняється рух молекул.T (0K)= 273,15+ t (0С);
- ш
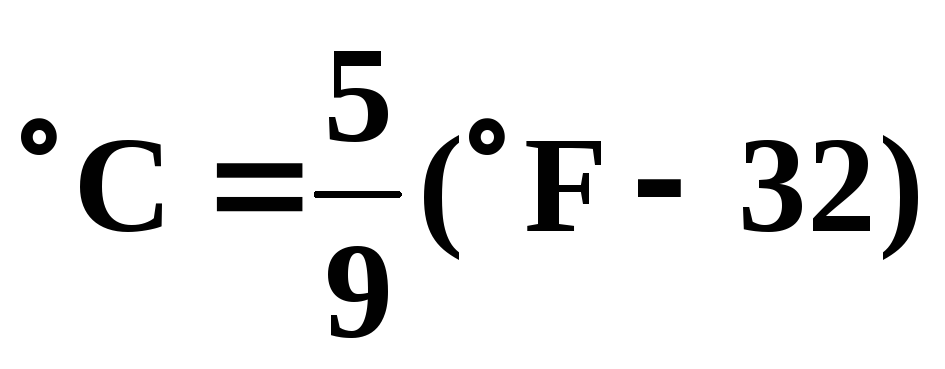 кала Фаренгейта0F. У цій шкалі температури плавлення льоду і кипі-
кала Фаренгейта0F. У цій шкалі температури плавлення льоду і кипі-
ння води прийняті відповідно за 320і 2120, .
У термодинаміці температуру виражають, як правило, за шкалою Кель-віна (абсолютна температура), ºК.
Тиск– величина, що характеризує відношення нормальної складової сили до одиниці площі, на яку діє сила.
Абсолютний тискРАвизначається як сумабарометричного(атмос--ферного) РБАРінадлишкового(манометричного) РМАНтиску
РА= РБАР + РМАН, Па, кПа, МПа.
У таблиці 1 наведені співвідношення між різними одиницями вимірювання тиску.
Таблиця 1
№
з/п
|
Одиниці вимірювання
|
Па
|
кгс/см2,
(ат)
|
кгс/м2,
(мм вод. ст.)
|
мм рт. ст.
|
бар
|
1
|
1 Па
|
1
|
1,02·10–5
|
0,102
|
7,5·10–3
|
10–5
|
2
|
1кгс/см2 =1ат
|
9,8·104
|
1
|
10000
|
735
|
0,98
|
3
|
1мм вод. ст. =
1 кгс/м2
|
9,8
|
10–4
|
1
|
7,35·10–2
|
9,8·10–5
|
4
|
1мм рт. ст.
|
133
|
1,3·10–3
|
13,6
|
1
|
1,3·10–3
|
5
|
1бар
|
105
|
1,02
|
10200
|
7,5·102
|
1
|
Густину різних газів робочих тіл за нормальних умов, тобто при температурі 0 ºС і тиску 0,1 МПа, можна визначити за їх молярним об’ємом, що дорівнює 22,4 нм3та масі одного кіломоля μ, кг,
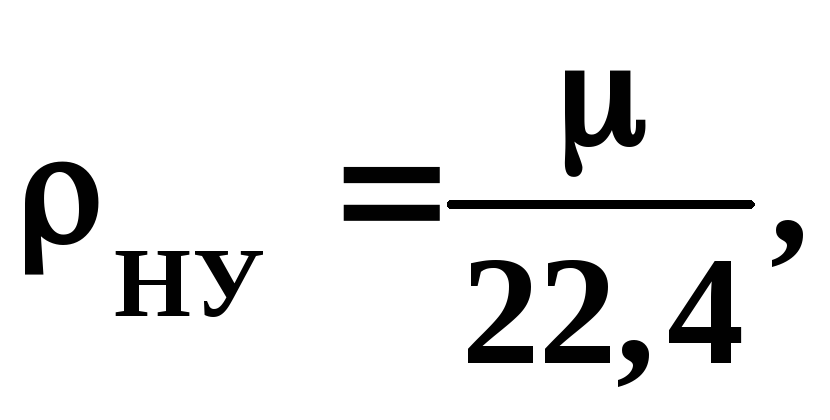 кг/нм3. (1)
кг/нм3. (1)
При збільшенні тиску і зменшенні температури газів їх густина зростає. При температурі t, ºС,і надлишковому тиску Р, МПа,густина газу визначається за формулою
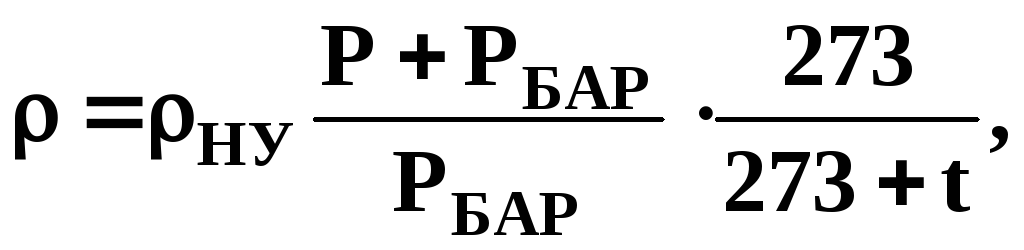 кг/м3, (2)
кг/м3, (2)
де РБАР– барометричний тиск за нормальних умов, РБАР=0,1МПа.
Питомим об’ємом υ є величина, обернена густині робочого тіла ρ, кг/м3,
υ=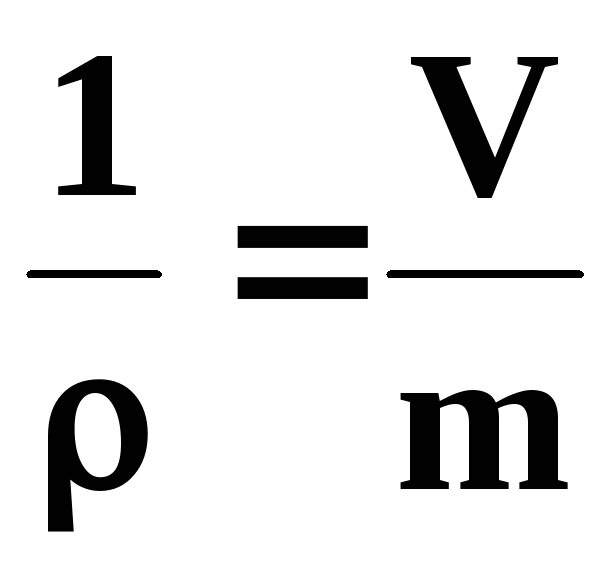 , м3/кг, (3)
, м3/кг, (3)
де V, m – об’єм та маса робочого тіла відповідно при заданих значеннях тиску РАі температури Т.
Параметри стану газу Р, υ, Т не є незалежними, один із них можна виразити через два інших. Рівняння, яке зв’язує між собою параметри стану газу, називається рівнянням стану системи(Клапейрона – Менделєєва) для ідеальних газів:
– для 1кг РТ: Р υ = RТ, (4)
– для довільної маси m РТ: РV = m RТ, (5)
де V – об’єм робочого тіла, м3,V = m·υ; R – газова стала,R = 8314/ μ, Дж/кг·гр.; Р – тиск газу, Па (абсолютний), Р= РА.
Тиск, котрийспричиняє тільки одна компонента газової суміші,називається їїпарціальним тиском.
Для визначення фазового стану робочого тіла важливо знати його критичні параметри(РК, ТК), при перевищенні яких газ ніяк не може бути скрапленим (переведеним у рідку фазу). При критичному стані густина і питомий об’єм рідини й пари над нею однакові. Критичні параметри робочих тіл, а також пара-
метри, при яких відбувається зміна фазового стану РТ наведені в [1,2] і табл.8.
Приведеними параметрамиробочого тіла називають відношення відповідних параметрів робочого тіла до їх критичних параметрів
ТПР =Т/ТК;РПР = Р/РК ;υпр = υ/υК. (6)
Важливими також є параметри, при яких відбувається зміна фазового ста-ну робочого тіла – його конденсація, або кипіння(пароутворення), tН, ТН, РН. Досягнення такого стану можливе відповідно при охолодженні або нагріванні робочого тіла при незмінному тиску. Зміна агрегатного стану можлива також при ізотермічній зміні тиску робочого тіла. Параметри насичення залежать від виду робочого тіла.
Так, при стискуванні газу чи пари вони стають спочатку насиченими, а потім при певному тиску починається їх конденсація.
Об’єм при цьому зменшується. Після переходу всієї пари у рідку фазу подальше збільшення тиску практично не приводить до зміни об’єму рідини.
Але якщо процес ізотермічного стискування проводити в інтервалі температур довкола критичної температури, то після часткової конденсації і проходження двофазового стану робочого тіла починається його перехід у пароподібний однофазовий стан. Таке пароутворення називається ретроградним. Воно спостерігається тільки в зоні високого тиску газів, а також для суміші газів.
Ретроградне, або зворотне, випаровування вуглеводнів при збільшенні тиску та їх ретроградна конденсація при падінні тиску приводять до утворення газоконденсатних родовищ нафти. В них при високому тиску над рідкою пластовою нафтою буде знаходитись парогазова фаза, до складу якої входить суміш газів і розчинених у них парів важких вуглеводнів, наприклад, керосинової або конденсатної фракції.
Якщо в родовищі вміст важких вуглеводнів не великий порівняно з газо-
подібними, то при існуючому пластовому тиску й температурі важкі вуглеводні
можуть повністю випаруватись і розчинитись у об’ємі газоподібних. У результаті пласт буде заповнений тільки парогазовою фазою.
Якщо ж важких вуглеводнів багато, то в результаті ретроградного випаровування може залишитись двофазна система: парогазова “шапка” і рідка пластова нафта, з якої випарувалась конденсатна фракція.
При розробленні таких родовищ тільки по нафтовій товщині в результаті зменшення тиску в пласті конденсат із газової “шапки” буде ретроградно переходити в рідку фазу, змочувати пористу породу пласта, розчинятись у нафті й втрачатись для видобутку.
Нафтовики зіткнулись із такими процесами тільки у 1932 р. Було експериментально визначено, яка рідка фаза нафти, що знаходиться у суміші з газоподібними вуглеводнями (CH4, C2H6, C3H8, C4H10 і ін.), при загальному високому тиску має більший парціальний тиск насиченої пари, ніж той, який вона має у чистому вигляді. Такі відхилення від загальних законів пружності пари і рівноважних співвідношень спостерігаються вже при тиску, більшому за 30-40 ат.
Прямі (неретроградні) процеси конденсації, як і випаровування, робочого тіла при порівняно невисокому тиску можна досягнути різними комбінаціями значень температури та тиску. Так, конденсація буде збільшуватись як у разі підвищення тиску при постійній температурі, так і при пониженні температури при постійному тиску.
Але при підвищенні тиску суміші газівпроцес конденсації одних компонентів із малим значенням РНі високою температурою кипіння ТНсупроводжується розчиненням і переходом у рідку фазу інших компонентів – із значно більшим парціальним тиском конденсації РНі низькими температурами кипіння. Параметри насичення газів у суміші залежать від складу суміші газів.
Наприклад, суміш, що складається із 10% метану ( tН= – 82 ºС ,
РН= 4,6МПа) і 90% пропану (tН= + 97 ºС, РК= 4,2 МПа),повністю конденсуєтьсяпри збільшенні тиску до 2,0 МПа при температурі +10 ºС. Таким чином, метан, для якого tН= –82 ºС,за наявності пропану повністю переходить у рідку фазу вже при температурі +10 ºС.
При ізобарному ж пониженні температури конденсація компонентів із ви- сокою температурою кипіння супроводжується значно меншим розчиненням і
переходом у рідку фазу парів із низькою температурою кипіння.
При збільшенні тиску РНвеличина температури, при якій відбувається кипіння і пароутворення робочого тіла ТН, будезростати.
Таким чином, для збільшення температури насичення пари необхідно підвищувати тиск робочого тіла.
Процес селективної (відповідно до значень ТН) конденсації суміші газів при зменшенні температури використовується у техніці при розділенні їх рідкої фази по окремих компонентах (низькотемпературна сепарація).
Рідкі нафтопродукти характеризуються величиною відносної густини, d20при температурі 20 ºС. Вона встановлюєтьсяпо відношенню густини нафто-продукту ρндо густини води ρв , визначеної при температурі +4 ºС (1000 кг/м3),
d = ρн / ρв. (7)
При збільшенні температури відносна густина нафтопродуктів та інших рідин зменшується. Перерахунок густини з температури 20 ºС до іншої у діапазоні від 0 ºС до 150 ºС здійснюється за формулою
де t – температура нафтопродукту, ºС; а – температурна поправка:
для 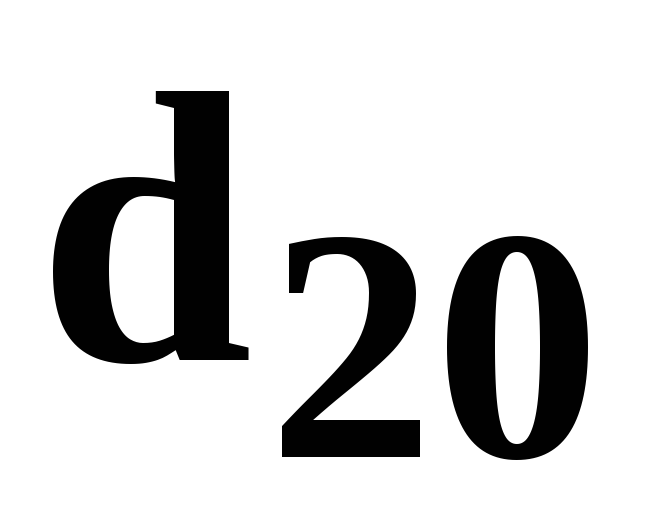 = 0,75 ÷ 0,8 величина а ≈ 0,0008; для
= 0,75 ÷ 0,8 величина а ≈ 0,0008; для = 0,85 ÷ 0,9 величина а ≈ 0,0007.
= 0,85 ÷ 0,9 величина а ≈ 0,0007.
При термодинамічних розрахунках використовують такі теплові властивості робочих тіл, як :
– теплоємність С, кДж/кг·гр, кДж/нм3 гр, кДж/кмоль·гр;
– теплота q, кДж/кг, ккал/кг;
– робота l, кДж/кг, ккал/кг;
– внутрішня енергія U, кДж/кг, ккал/кг;
– ентальпія i, кДж/кг, ккал/кг;
– ентропія S, кДж/кг гр, ккал/кг·гр;
– теплота випаровування і конденсації r, кДж/кг, ккал/кг;
– теплота згорання палива  , кДж/кг, кДж/нм3, ккал/кг, ккал/ нм3.
, кДж/кг, кДж/нм3, ккал/кг, ккал/ нм3.
Усі вказані величини віднесені до 1 кг, або 1 м3робочого тіла, і тому мають назвупитомиххарактеристик.
Питома середня теплоємність робочого тіла (РТ) – кількість теплоти, що необхідна для зміни температури 1кг (масова)Сm, або 1м3(об’ємна)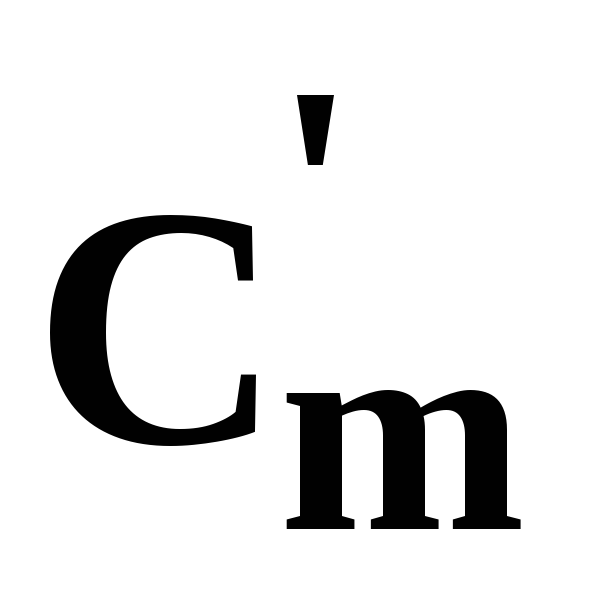 , робочого тіла на 1ºС від t1до t2. Залежно від виду термодинамічного процесу, в якому відбувається зміна температури, в розрахунках використовують ізохорну Сmυ, ізобарнуСmрі політропнуСmп теплоємності.
, робочого тіла на 1ºС від t1до t2. Залежно від виду термодинамічного процесу, в якому відбувається зміна температури, в розрахунках використовують ізохорну Сmυ, ізобарнуСmрі політропнуСmп теплоємності.
Теплоємність збільшується із підвищенням температури робочого тіла.Узв’язку з цим необхідно розрізняти середнюСmта істиннуСтеплоємність.
Я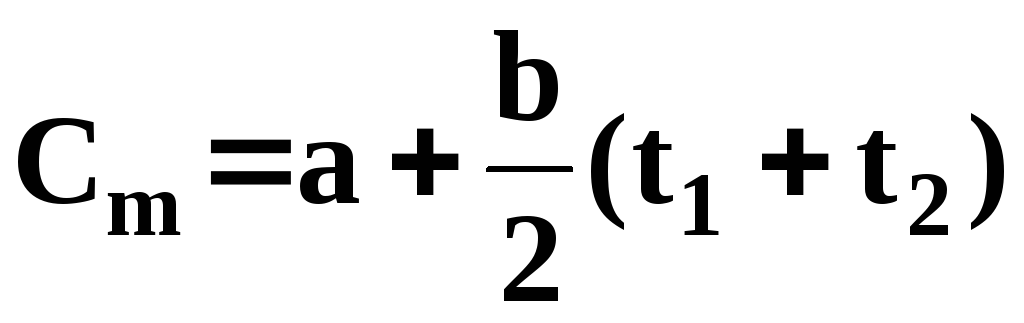 кщо величину теплоємності визначають за довідковою літературою як середнє значення у діапазоні зміни температури РТ від t1до t2, наприклад, згідно із залежністю
кщо величину теплоємності визначають за довідковою літературою як середнє значення у діапазоні зміни температури РТ від t1до t2, наприклад, згідно із залежністю
,
де a i b – довідкові сталі для заданого газу, то визначувана величина Сmєсередньоюпитомою теплоємністю у діапазоні змін температури від t1до t2.
Якщо ж теплоємність визначається при певному значенні температури t робочого тіла за умови, що Δt=t2– t1→0, відповідно до довідкових залежностей
C = a + bt + сt2,
то в якості С маємо істиннупитому теплоємність. У теплотехнічних розрахунках нелінійні залежності теплоємності від температури з достатньою точністю можна замінити на лінійні виду С = a + b·t, що наведені у довідковій літературі ( додаток А).
Теплоємність ідеальних газів залежить не тільки від їх температури, а й від їх атомності і виду процесу.
Теплоємність реальних газів залежить від виду газу, характеру процесу, температури і тиску.
Технічні розрахунки виконують в основному за величиною середньої теплоємності.
Для приблизних розрахунків при невисокій температурі значення середніх теплоємностей Сmгазів приймають незалежно від температури згідно з даними таблиць 2 і 3 за величиною мольних середніх теплоємностей μСm.
Таблиця 2
Гази
|
Мольна теплоємність μСm,
кДж/кмоль·гр
| |
Ізохорна μСυ
|
Ізобарна μСр
| |
Одноатомні (Аr, Не, Сl…)
|
12,56
|
20,93
|
Двохатомні (N2, О2, СО…)
|
20,93
|
29,31
|
Трьох- і багатоатомні (СО2, Н2О, SО2…)
|
29,31
|
37,68
|
Основні співвідношення між указаними теплоємностями та деякі залежності для визначення кількості теплоти наведені в таблиці 3.
Якщо розрахунки q виконуються через об’ємнусередню теплоємність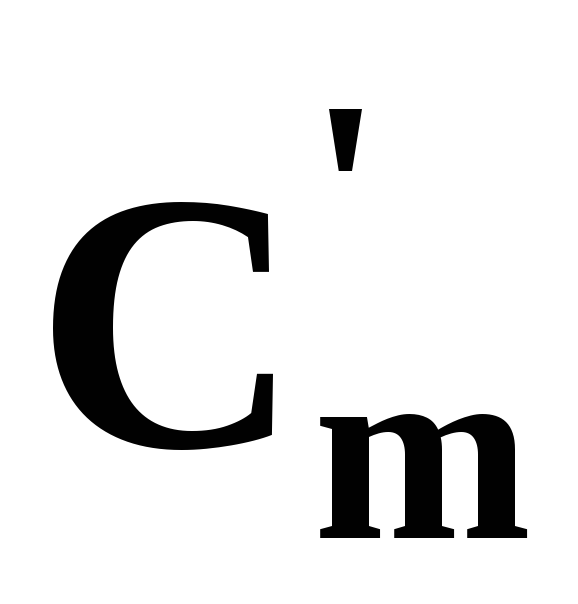 , то питома кількість теплоти q’ буде віднесена до 1м3і має розмірність кДж/ м3.
, то питома кількість теплоти q’ буде віднесена до 1м3і має розмірність кДж/ м3.
В адабатному процесі теплообмін відсутній і кількість теплоти у такому процесі рівна нулю, qS=0. Таким чином,теплота є функція процесу.
Для m (кг) робочого тіла кількість теплоти розраховується згідно із залежністю
Q = m· q = mCm(t2 – t1), кДж, (9)
де q – питома кількість теплоти, віднесена до 1 кг РТ, кДж/кг.
Для об’єму V, м3, кількість теплоти визначається через її питому кількістьq, віднесену до 1 м3робочого тіла
Якщо об’єм РТ (V) виразити через його масу, то можна повернутись до залежності (9)
де m = Vρ, кг;ρ– густина робочого тіла при відомих значеннях тискуРі температуриТробочого тіла, кг/м3.
Якщо в (9) підставити секундні витрати робочого тіла mc (кг/с), то будуть одержані секундні витрати теплоти, що мають розмірність кДж/с = кВт,
Таблиця 3
№
з/п
|
Вид теплоємності
|
Од. вимірювання
|
Ізохорна Сmυ
|
Ізобарна Сmр
|
ППолітропна Сmп
|
Об’ємна середня
|
Масова середня Сm
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
1
|
Мольна середня μСm
| 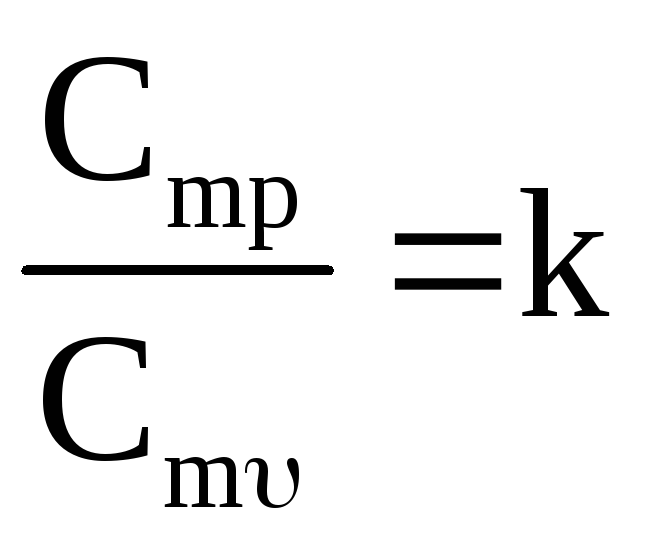
k – показник адіабати
|
Сmр– Сmυ= R
R – постійна газова стала
|
μСm=Сm·μ
| |||
2
|
Об’ємна середня
| ||||||
3
|
Масова середня
Сm= μСm/μ
|
μСmр– μСmυ= Rμ,
|
Сm=
|
–
| |||
4
|
ізохорна,
υ= const, Сmυ
|
–
|
qυ = Сmυ· (t2–t1),
| ||||
5
|
ізобарна,
Р= const, Сmр
|
Сmр= Сmυ·k
|
qр = Сmр· (t2–t1),
| ||||
6
|
політропна,
n= const, Сmп
|
Сmп=
|
qп = Сmп· (t2–t1),
| ||||
де q – питома кількість теплоти, необхідної для зміни температури 1кг робочого тіла від t1до t2при ізохорному qυ, ізобарному qрта політропному qппроцесах, у кДж/кг.
Теплота – це енергія, яку робоче тіло отримує або віддає в процесах теплообміну без здійснення роботи. При Q > 0 теплота отримується, t2> t1, а якщо Q < 0 – то віддається і t2< t1. При t1= t2кількість теплоти Q = 0.
При теплообміні між кількома РТ або РТ і навколишнім середовищем кількість теплоти, що віддається більш нагрітим тілом, Q1дорівнює кількості теплоти, яку отримує холодніше тіло,Q2
Q1 = Q2; Q1 – Q2 = 0. (10)
Залежність (10) називається рівнянням теплового балансу. Воно покладено в основу всіх розрахунків, повязаних із передачею теплоти від одного робочого тіла до другого.
Комментарии
Отправить комментарий