Тема 19: Трикомпонентні системи.
На відміну від діаграм стану двокомпонентних систем, склади яких зображені точками на прямий, для зображення складу трикомпонентних систем використовують так званий концентраційний трикутник, вершинам якого відповідають чисті компоненти, а трикомпонентні суміші представлені точками на площині трикутника. Для того, щоб знайти на концентраційному трикутнику АВС фігуративну точку, наприклад, складу А – 30 %, В – 60 % і С – 10 % на стороні АВ від точки А відкладають відрізок АК, який відповідає 60 % В, від точки В – відрізок ВК’, який відповідає 30 % А. З отриманих точок К і К’ проводять прямі, паралельні двом іншим сторонам трикутника, тобто АС і ВС. Точка перетину і буде фігуративною точкою f, яка відповідає заданому складу (рис.4.16).
На перпендикулярах до площини трикутника, які проведені до фігуративних точок, відкладають величини досліджуваних властивостей, наприклад температури плавлення сумішей, потім з’єднують кінці цих перпендикулярів поверхнею і отримують просторову діаграму склад-властивість трикомпонентної системи. Далі через цю поверхню проводять ряд січних площин, що паралельні площині складу трикутника і отримують в точках перетину лінії (ізолінії, ізотерми), кожна з яких відповідає певному значенню властивості. Потім ці лінії проектують ортогонально на площину трикутника і одержують плоску діаграму склад-властивість трикомпонентної системи.
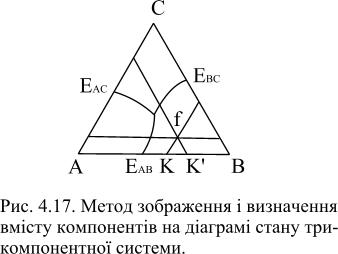 |
Рис.4.16. Метод зображення визначення вмісту
компонентів на діаграмі стану трикомпонентної системи
|
При визначенні шляхів кристалізації у трикомпонентних системах користуються правилами:
1. При первинній кристалізації фази або будь-якого компонента із суміші, яка знаходиться в полі виділення цього компонента, склад рідкої фази змінюється по прямій, що проходить крізь вершину цього компонента і фігуративну точку суміші, віддаляючись від неї.
2. У випадку однієї подвійної сполуки S, що плавиться конгруентно, точка її складу знаходиться в межах контуру ЕCSEBCSEAS поля первинної кристалізації, а у випадку сполуки, що плавиться інконгруентно – поза контуром EASEACS і поля його первинної кристалізації.
3. Якщо пряма, яка з’єднує точки складів двох твердих фаз або продовження цієї прямої, перетинає граничну криву (або її продовження), що розділяє поля первинної кристалізації цих же двох фаз, на граничній кривій в міру віддалення від вказаної точки перетину температури завжди знижуються.
4. Ознакою потрійної евтектичної точки ЕАВС є розташування стрілок на трьох граничних кривих. Евтектична точка завжди міститься в елементарному фазовому трикутнику, у вершинах якого розташовані ці ж фази, поля перинної кристалізації яких знаходяться в евтектичній точці. Тому при відніманні тепла у евтетики ЕАВС одночасно кристалізуються вказані три рівноважні фази, що можна зобразити рівнянням реакції:
5. Ознакою нонварінтної точки подвійного підйому є таке розташування стрілок на граничних кривих:
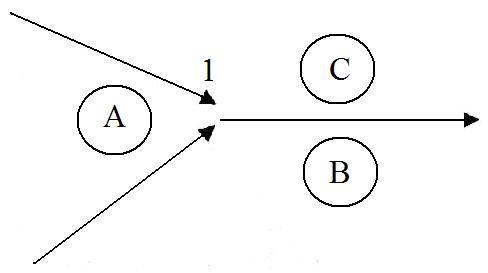
Точка подвійного підйому 1 міститься поза елементарним фазовим трикутником і протилежить вершині фази А. Подальший шлях кристалізації від точки 1 по граничній кривій відходить від поля первинної кристалізації А. Тому при відніманні тепла фази В і С кристалізуються, а фаза А розчиняється.
6. Ознакою нонваріантної точки подвійного опускання є таке розташування стрілок на граничних кривих:
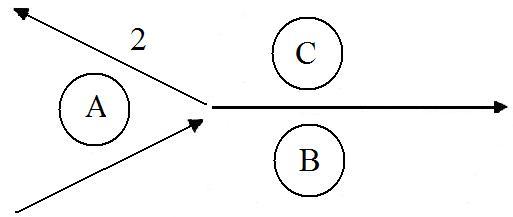
Точка подвійного опускання 2 розташована в зовнішньому куті фазового трикутника у вершині фази С і протилежна стороні з фазами А і В. При охолодженні шлях кристалізації може проходити по граничній кривій, де рідина рівноважна з твердими фазами А і С, або по кривій з рівноважними твердими фазами В і С та рідиною, тобто при відніманні тепла фази А і В розчиняються.
7. При графічному визначенні співвідношення кількості фаз або їх вмісту застосовують правило важеля.
8. При аналітичному способі розрахунку кількості фаз по діаграмах стану враховують наступні випадки:
а) в системі є компонент, який залишається в рідкій фазі, тоді, коли інші частково кристалізуються і частково залишаються в рідині;
б) в твердій фазі кристалізуються всі компоненти.
Якщо є компонент, що не викристалізувався, кількість розплаву Р (%), дорівнює:
а якщо компонент, що кристалізується, відсутній:
де Х, х, х’ – вміст компонента відповідно у вихідній суміші, в розплаві і твердій фазі, %.
Розглянемо найпростішу діаграму розчинності трикомпонентної системи. На діаграмі фігуративна точка f відповідає складу вихідного розчину, що підлягає випарюванню; ЕАВЕ, ЕАСЕ, fкЕ – лінії сумісної кристалізації речовин, що розмежовують поля кристалізації прилеглих речовин; Т1 – ізотерма розчинності, при температурі якої відбувається процес випарювання.
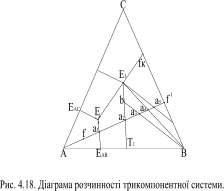 |
Рис. 4.17. Діаграма розчинності трикомпонентної системи
|
Промінь випаровування Аf1 на діаграмі визначають шляхом проведення з’єднувальної прямої, яка проходить через вершину трикутника А і фігуративну точку f. Промінь випаровування на своєму шляху перетинає лінію сумісної кристалізації ЕАВЕ і ізотерму розчинності Т1. Перетин з лінією ЕАВЕ у точці а1 вказує, що кристалізується речовина В. Температура кристалізації в цій точці нижча за температуру Т1, при якій відбувається процес випарювання, тому стану насичення в неї не досягається. При досягненні точки а2 розчин стає насиченим за речовиною В. У точці а3 розчин стає пересиченим і розпадається на тверду речовину В і насичений розчин з температурою Т1.
Для визначення складу розчину в точці а3 через вершину трикутника В і точку а3 проводять з’єднувальну пряму Вb до перетину її з ізотермою Т1 в точці b, яка відповідає цьому складу.
Внаслідок подальшого випарювання насичений розчин збіднюватиметься на речовину В, а фігуративна точка насиченого розчину переміщуватиметься у напрямку до евтектики Е1.
Евтектика Е1 – моноваріантний стан при температурі Т1, і її склад зберігатиметься доти, поки в системі буде рідка фаза.
Для визначення максимальної кількості чистої речовини В, яка кристалізується при випарюванні розчину f, проводять з’єднувальну пряму вершин трикутника В з точкою евтектики Е1. Стан точки перетину а4, яка лежить на прямій ВЕ1, визначає кількість твердої фази В. Точка розчину при цьому переміститься в евтектичну точку Е1, і розчин стане насиченим також і речовиною С. Склад розчину буде залишатися незмінним, евтонічним, і його точка Е1 буде нерухома до повного висушування розчину. Тверда фаза буде збагачуватися речовиною С, і тому точка її складу буде переміщуватися із С по стороні трикутника СВ. При повному висушуванні системи точка системи і точка твердої фази співпадуть в точці f’, а розчин зникне.
Згідно правила важеля для системи, яка, наприклад, знаходиться в точці а5:
Співвідношення речовин В і С у твердій фазі точки f’ є таким самим, як і в розчині f, що підлягає випарюванню.
Тема 20: Закон распределения Нернста-Шилова
Тема 20: Закон распределения Нернста-Шилова
Для получения материалов с определенными и контролируемыми свойствами исходные компоненты подвергают различным методам очистки. Наиболее эффективные методы очистки, осуществляемые при фазовых превращениях исходных веществ из одного агрегатного состояния в другое, основаны на различной растворимости компо- нентов системы (примесей) в двух равновесных фазах. Это различие количественно характеризуется коэффициентом распределения — отношением активностей (концентраций) данного компонента в со- существующих равновесных фазах.
Этот пример является частным случаем общей закономерности, кото-
рая носит название закона распределения Нернста-Шилова: отноше-
ние активностей (концентраций) вещества, распределяющегося между двумя несмешивающимися жидкостями или газами, явля- ется при каждой данной температуре величиной постоянной. Как показано в разделе 3.1 в открытых термодинамических системах ком- понент будет переходить из фазы (1) в фазу (2), если его химический по- тенциал в первой фазе больше, чем во второй (3.129), т. е.
µ1k > µ2k .
При достижении равновесия химические потенциалы данного компо- нента в обеих фазах при данной температуре равны между собой, т. е.
µ1k = µ2k .
При этом его равновесные активности (концентрации) в обеих фазах остаются неизменными.
Зависимость химического потенциала компонента от активности (концентрации) выражается уравнениями
µk = µ0k + RT lnak
или, как уже было показано ранее (1.103),
µk = µ0k + RT lnCk ,
|
(3.138)
| |
где ak = f · Сk — активность компонента в данной фазе
|
в моль/л
| |
или экв/л;
| ||
Сk —
|
концентрация компонента в данной фазе, моль/л или экв/л;
| |
f —
|
коэффициент активности, принимающий значения мень-
| |
ше или равно 1, т. е. f ≤ 1. Для разбавленных растворов f = 1 и ak = Ck, моль/л;
µ0k — стандартный химический потенциал компонента в данной фа- зе при 298 К.
Исходя из уравнений (3 . 130) и (3 . 138) для двух рав- новесных фаз, запишем
µ0(1)k + RT lnC(1)k = µ0(2)k + RT lnC(2)k ;
при этом µ0(1)k ≠ µ0(2)k и при T = const являются величинами постоянными, тогда
0(2)
|
0(1)
|
(1)
|
µk
|
− µk
|
= ln C(2)k .
|
RT
|
Ck
| |
Так как все члены, входящие в левую часть уравнения, постоянны, то
ln C(1)k
|
= K
|
или
|
C(1)k
|
= K ,
|
(3.139)
|
C(2)k
|
C(2)k
|
где К — термодинамическая константа (коэффициент) распределения. Если распределяемый компонент диссоциирует или ассоциирует в
данных фазах, то выражение (3.139) принимает вид
= C(1)(1− α )
K к 1 ,
C(2)к (1− α2 )
где α1 и α2 — степени диссоциации или ассоциации компонента в первой и второй фазах соответственно.
Численное значение коэффициента распределения (К) зависит от природы равновесных фаз, природы распределяемого между ними компонента, от температуры и не зависит от относительного количества равновесных фаз и исходной концентрации распре-деляемого компонента.
Закон распределения Нернста-Шилова находит широкое применение в решении разнообразных практических задач.
Экстракцией называется физический процесс разделения гомо- генной смеси (раствора) двух и более веществ на составляющие компоненты с помощью вспомогательного растворителя — экст- рагента, добавление которого вызывает расслаивание раствора.
Экстрагент выбирается с таким расчетом, чтобы он не смешивался с ис- ходным раствором и хорошо растворял в себе экстрагируемый компо- нент. При этом экстрагирование будет тем полнее, чем больше коэффи- циент распределения отличается от единицы. Например, экстрагентом для извлечения йода из воды может служить четыреххлористый углерод (CCl4), коэффициент распределения при этом равен
K = CI2 (CCl4 ) = 85,5 .
CI2 (H2O)
Следует заметить, что полноту экстрагирования можно увеличить, если имеющийся запас экстрагента использовать по частям, учитывая, что все процессы идут до установления равновесия.
Извлечение вещества жидкостью из жидкости называется жидкост- ной экстракцией, газа жидкостью или твёрдой фазой — газовой аб- сорбцией, твёрдого вещества жидкостью — выщелачиванием.
Различная растворимость примесей в расплаве и соприкасающейся с ним твёрдой фазе количественно характеризуется коэффициентом сегрегации (КC):
Cтв
KC = Cпрж ,
пр
где Cпртв — концентрация примеси в твёрдой фазе;
Cпрж — концентрация примеси в жидкой фазе (расплаве).
Например, при очистке полупроводниковых материалов от приме- сей методами направленной кристаллизации расплава или зонной плавки примеси, для которых КC < 1 (Al, Ga в Ge: КC=0,01; In в Ge: КC = 0,001; Те и Bi в Ge: КC = 4·10-5), концентрируются в зоне расплава, а в зоне кристаллизации образуется слой вещества более чистого отно- сительно указанных примесей. При этом, чем сильнее отличается от единицы в меньшую сторону значение коэффициента сегрегации, тем эффективнее очистка от примесей.
Примеси, для которых КC > 1 (В в Ge KC = 17,3), концентрируются в твёрдой фазе, и эти методы очистки малоэффективны.
Комментарии
Отправить комментарий