Тема 35: Реакції катіонів VI групи, групи реактивів.
Груповим реагентом на катіони 6 аналітичної групи є надлишок водного розчину амоніаку, який переводить катіони в розчинні аміачні комплекси ( [Ni(NH3)6]2+ та ін. аналогічні). Сполуки меркурію(ІІ) розчиняються лише в концентрованому розчині амоніаку в присутності натрій хлориду .
Груповим реагентом на катіони 6 аналітичної групи є розчини їдких лугів, які утворють з катіонами малорозчинні у воді осади гідроксидів (або основних солей). Катіони цієї групи можуть проявляти змінний ступінь окиснення. Тому для них властиві реакції окиснення , які часто є характерними якісними реакціями.
Важливіші реакції виявлення.
1. Реакції йонів Co2+.
1.1. NH4SCN або KSCN – амоній або калій тіоціанат.
У пробірку поміщають 4-5 краплин розчину солі кобальту, добавляють стільки ж насиченого розчину NH4SCN або KSCN, 1-2 кристалики натрій фториду, суміш амілового спирту й етеру (1:1) об’ємом 0,5 мл, а тоді збовтують. У присутності кобальту неводний шар після відстоювання забарвлюється в синій колір.
Co(NO3)2 + 4KSCN = K2[Co(SCN)4] + 2KNO3
Co2+ + 4SCN- = [Co(SCN)4]2-
1.2. (NH4)2[Hg(SCN)4] – діамоній тетра(тіоціанато)меркурат (ІІ) .
У пробірку поміщають 4-5 краплин розчину солі кобальту, добавляють 1 краплю розчину ZnSO4 і 2-3 краплі розчину (NH4)2[Hg(SCN)4]. Спостерігають утворення синього осаду. Реакції заважають йони Cu2+, Fe3+, Ni2+.
CoSO4 + 2(NH4)2[Hg(SCN)4] = Co[Hg(SCN)6] + 2(NH4)2SO4
Co2+ + [Hg(SCN)4]2- = Co[Hg(SCN)6]
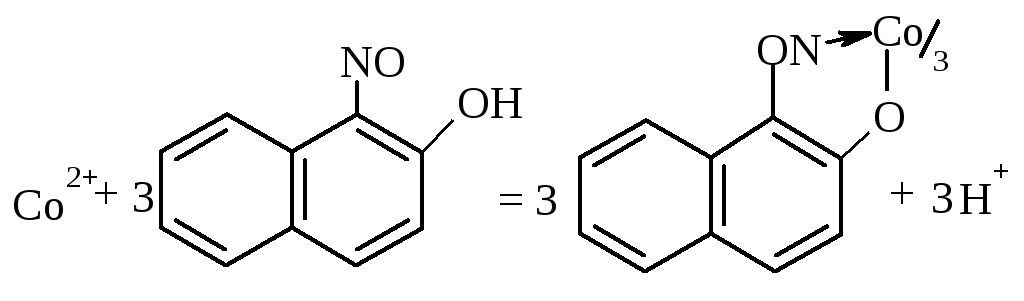
1.3. 1-нітрозо-2-гідроксинафталін – реактив Ільїнського .
У пробірку поміщають 4-5 краплин розчину солі кобальту, добавляють 3-4 краплі розчину HCl і нагрівають до кипіння, додають свіжо приготовлений насичений розчин 1-нітрозо-2-гідроксинафталіну і знову нагрівають. У присутності кобальту, залежно від концентрації, розчин забарвлюється в червоний колір або випадає червоно-бурий осад.
2. Реакції йонів Ni2+.
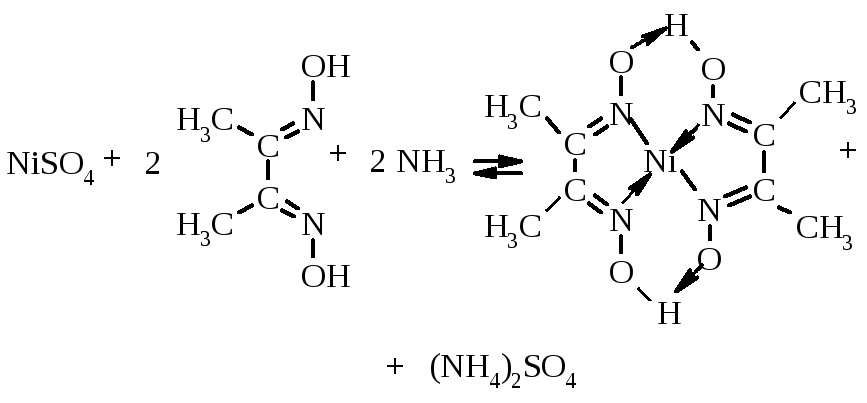
2.1. Диметилгліоксим – реактив Чугаєва
На смужку фільтрувального паперу наносять 1 краплю розчину солі нікелю, 1 краплю розчину диметилгліоксиму і тримають смужку над склянкою з концентрованим розчином аміаку. У присутності нікелю, залежно від концентрації, розчин забарвлюється в рожевий колір або випадає червоно-бурий осад.
2.2. NH3·H2O – розчин амоніаку.
У пробірку поміщають 4-5 краплин розчину солі нікелю, додають 3-4 краплі розчину NH3·H2O. Спостерігають за випаданням зеленого осаду Ni(OH)2, який поступово розчиняється в надлишку розчину амоніаку.
NiSO4 + 2NH3 + 2H2O = Ni(OH)2 + (NH4)2SO4
Ni(OH)2 + 6NH3 = [Ni(NH3)6]2+ + 2OH-
3. Реакції йонів Cu2+.
3.1. NH3·H2O – розчин амоніаку.
У пробірку поміщають 4-5 краплин розчину солі купруму, додають 3-4 краплі розчину NH3·H2O. Спостерігають за випаданням осаду, який поступово розчиняється в надлишку розчину амоніаку з утворенням аміакату купруму інтенсивного синього кольору.
2CuSO4 + 2 NH3·H2O = Cu2(OH)2SO4 + (NH4)2SO4
Cu2(OH)2SO4 + 6 NH3·H2O (K.) + (NH4)2SO4 = 2[Cu(NH3)4]SO4 + + 8H2O
Cu2+ + 4 NH3· H2O = [Cu(NH3)4]2+ + 4H2O
3.2. KI – калію йодид.
У пробірку поміщають 1-2 краплини розчину солі купруму, додають 3-4 краплі розчину KI. Спостерігають утворення осаду CuI та виділення вільного йоду, який ідентифікують за допомогою крохмалю (йодокрохмального папірця).
2CuSO4 + 4 KI = 2CuI + I2 + 2K2 SO4
3.3. (NH4)2[Hg(SCN)4] – тетрароданомеркуріат (ІІ) амонію.
У пробірку поміщають 4-5 краплини розчину солі купруму, добавляють 2-3 краплі розчину (NH4)2[Hg(SCN)4]. Спостерігають утворення “смарагдово-зеленого” осаду. Реакції заважають йони Fe3+, Ni2+.
CuSO4 + 2(NH4)2[Hg(SCN)4] = = Cu [Hg(SCN)6] + 2(NH4)2SO4
Cu2+ + [Hg(SCN)4]2- = Cu [Hg(SCN)6]
4. Реакції йонів Cd2+.
4.1. Na2S – натрію сульфід.
У пробірку поміщають 1-2 краплини розчину солі кадмію, додають 3-4 краплі розчину Na2S. Спостерігають утворення “канарково-жовтого” осаду сульфіду кадмію. Реакції заважають іони Hg, Bi, Cu та інші.
Cd(NO3)2 + H2S = CdS + 2HNO3
Cd2+ + H2S = CdS + 2H+
4.2. Дифенілкарбазон
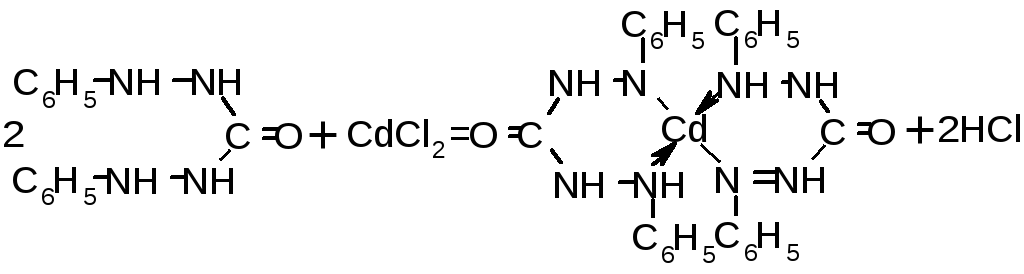
5. Реакції йонів Hg2+.
5.1. KI – калій йодид.
На смужку фільтрувального паперу наносять 1 краплю розчину солі меркурію (ІІ), 1 краплю розчину KI. Спостерігають утворення плями червоно-оранжевого кольору. Осад HgI2 легко розчиняється в надлишку KI з утворенням безбарвного калій тетрайодомеркурату(ІІ). Лужний розчин цієї солі називається реактивом Неслера.
Hg(NO3)2 + 2KI = HgI2 + 2KNO3
Hg2+ + 2I- = HgI2
HgI2 + 2KI = K2[HgI4]
5.2. SnCl2 – станум (ІІ) хлорид.
У пробірку поміщають 1-2 краплини розчину хлоридної солі меркурію(ІІ), додають 3-4 краплі розчину SnCl2 (можна всипати суху сіль). Спостерігають утворення білого осаду меркурію (І) хлориду чи виділення чорного осаду металічної ртуті..
SnCl2 + 2HgCl2 = SnCl4 + Hg2Cl2
Hg2Cl2 + SnCl2 = SnCl4 + 2Hg
Sn2+ + 2Hg2+ + 2Cl- = Hg2Cl2 + Sn4+
Hg2Cl2 + Sn2+ = Sn4+ + 2Hg + 2Cl-
Тема 36: Схема аналізу суміші катіонів VI групи.
Аналіз суміші катіонів 6 аналітичної групи. Виявлення присутності катіонів дробним методом:
1. Йони NH4+ дією лугу.
2. Йони Mn2+ окисненням бісмутатом до манганатної кислоти.
3. Йони Fe3+ дією амонію тіоціанату.
4. Йони Fe2+ дією К3[Fe(CN)6] у солянокислому середовищі.
5. Йони Cu2+ дією калію йодиду в присутності толуену.
6. Йони Ni2 + дією диметилгліоксиму в амонійно-лужному середовищі.
7. Йони Со2+ дією кристалічного амоній тіоціанату в присутності амілового спирту та етеру .
8. Йони Sn2+ дією солей бісмуту в лужному середовищі.
9. Йони Hg22+, Hg2+ за допомогою мідної дротини.
Попередні дослідження:
1. Якщо розчин безбарвний, то відсутні йони Co2+, Cr3+, Ni2+, Cu2+ і, можливо, Fe3+
2. До невеликої кількості досліджуваного розчину добавити 2 М розчин HCl. Якщо осад не випадає, то відсутні йони Hg22+ , Ag+ і, можливо, Pb2+ .
3. До невеликої кількості досліджуваного розчину додають 2 М розчин H2SO4. Якщо осад не випадає, то відсутні йони Ba2+, Pb2+, Hg22+ і, можливо, Ca2+.
4. До окремої порції добавляємо розчин натрій гідроксиду й олова (ІІ) хлориду. Якщо чорний осад не з’являється, можна вважати, що в розчині немає катіонів Hg22+, Hg2+, Ві3+ .
[Cu(NH3)4]2+, [Cd(NH3)4]2+, [Co(NH3)4]2+, [Ni(NH3)6], [Hg(NH3)4]
1M H2SO4 + 2M Na2S2O3
нагрівання



Розчин: Cd2+, Co2+, Ni2+
Осад:Cu2S, HgS

Гліцерин 2M NH4OH, 3M HNO3
Білий осад: Cd(OH)2

 Диметилгліоксим
Диметилгліоксим
Малиново-червоний осад: Ni(HDm)2
Осад: HgS
Розчин: іони Cu2+

NH4SCN HCl +
NH3•Н2О HNO3
Синє забарвлення:
[Co(SCN)4]
Розчин: іони Hg2+
K4[Fe(CN)6] SnCl2
Білий осад Hg2Cl2
Буро-червоний осад: Cu2[Fe(CN)6]
Досліджуваний розчин суміші катіонів усіх аналітичних груп може бути без осаду, а може містити осад. Розглянемо хід аналізу досліджуваного розчину в першому й другому випадку.
Аналіз осаду
Якщо в досліджуваному розчині є осад, то він може мати такий склад:
а) продукти гідролізу солей бісмуту та олова;
б) хлориди катіонів ІІ групи;
в) сульфати катіонів ІІІ групи та йони Hg22+, Pb2+, Ag+ при достатній концентрації останніх.
В такому випадку в досліджуваний розчин (з осадом) вливають невелику кількість 2 М розчин НNO3 і нагрівають до кипіння. При цьому продукти гідролізу стануму та бісмуту переходять у розчин, а хлориди й сульфати залишаються в осаді. Осад відділяють і окремо аналізують осад 1 і фільтрат.
Аналіз осаду 1.
В осаді 1 можуть бути хлориди катіонів ІІ групи або сульфати барію, кальцію, плюмбуму, аргентуму, меркурію(І).
Аналіз хлоридів проводять за систематичним ходом аналізу катіонів ІІ групи.
Аналіз сульфатів у відсутності хлоридів.
Осад обробляють гарячою водою. При цьому в розчин перейде йон Ag+. Осад відфільтровують, а фільтрат перевіряють на присутність у ньому йону Ag+ за допомогою калій йодиду. Осад решти сульфатів обробляють сумішшю 30% амоній ацетату та 2 М розчину амоній гідроксиду. При цьому в розчин переходить йон Pb2+, а від присутності йону Hg22+ осад стає чорним. Осад відділяють і діють на нього концентрованою HNO3 при нагріванні. При цьому в осаді залишаються сульфати катіонів ІІІ групи, а в розчині буде йон Hg2+, який виявляють характерною реакцією.
Осад обробляють концентрованим розчином амоній сульфату. При цьому йон Са2+ переходить у розчин і його виявляють характерною реакцією. Сульфати, що залишились в осаді, переводять у карбонати, розчиненням в ацетатній кислоті й аналізують по ходу аналізу суміші катіонів ІІІ групи.
Ознайомитися з лекцією. Зробіть стислий конспект.
Надішлить фото-звіт конспекту на Viber за номером +380997066912
Комментарии
Отправить комментарий