Тема 31: Лабораторная работа № 4
Качественные реакции катионов четвертой аналитической группы
Цель работы:изучить качественные реакции на катионы IV аналитической группы,
ознакомиться с ходом разделения смеси катионов четвертой аналитической группы.
Реактивы:см. табл. 6.
Оборудование и материалы:пробирки; штативы;
спиртовки; стаканы химические; стеклянные палочки; воронки; бумажные фильтры;
нихромовая проволока; плитка.
Общая характеристика катионов четвертой аналитической группы
кислотно-основного метода
Катионы пятой аналитической группы включают: Zn2+,Al3+,Sn2+,Cr3+,As3+,As5+.
Групповым реагентом на катионы этой группы катионов является гидроксид натрия
(обычно избыток) в присутствие пероксида водорода, который осаждает катионы в
виде гидроксидов, растворимых в избытке реактива с образованием
гидроксокомплексов:
Al3+ +
3OH– = Al(OH)3 Al(OH)3 + 3OH– =
[Al(OH)6]3–
Cr3+ +
3OH– = Cr(OH)3 Cr(OH)3 + 3OH– =
[Cr(OH)6]3–
Zn2+ +
2OH– = Zn(OH)2 Zn(OH)2 + 2OH– =
[Zn(OH)4]2–
Sn2+ +
2OH– = Sn(OH)2 Sn(OH)2 + 4OH– =
[Sn(OH)6]4–
Осадки гидроксидов катионов четвертой группы не растворяются в водном
аммиаке, за исключением гидроксида цинка, который растворяется в водном
растворе аммиака с образованием аммиачного комплекса [Zn(NH3)4]2+.
Открыть катионы алюминия можно капельным методом реакцией с ализарином.
Открытию алюминия мешают катионы хрома, цинка, олова. Мешающие катионы можно
перевести в малорастворимые соединения гексацианоферратом (II).
Присутствие олова доказывают реакциями с солями ртути и солями висмута в
щелочной среде. Ртуть и висмут при реакции с оловом восстанавливаются до
металлического состояния и выпадают в виде черных осадков.
* При осуществлении реакций катионов с органическими реагентами необходимо
соблюдать условия проведения этих реакций.
В отчете уравнения реакций ионного обмена записываются
в молекулярной и сокращенной ионной формах. Окислительно-восстановительные
процессы оформляются с указанием окислителя и восстановителя и записью
уравнения в молекулярной форме и электронного баланса.
Таблица - Качественные реакции катионов
четвертой аналитической группы
Реагент
|
Продукты
аналитических реакций катионов
|
|||
Zn2+
|
Al3+
|
Sn2+
|
Cr3+
|
|
Щелочь
(раствор)
NaOH или KOH
|
Белый
аморфный осадок гидроксида цинка, растворимый в избытке щелочи.
|
Белый
осадок гидроксида алюминия, растворимый в избытке щелочи, кислотах, но не
растворяется в аммиаке и NH4Cl.
|
Белый
осадок гидроксида олова, растворимый в избытке щелочи, кислотах.
|
Серо-зеленый
или сине-фиолетовый осадок гидроксида хрома, растворяется в избытке реагента,
частично в аммиаке.
|
Гидроксид
аммония
|
Белый
аморфный осадок гидроксида цинка, растворимый в избытке реагента с
образованием бесцветного комплекса цинка.
|
Белый
осадок гидроксида алюминия, не растворимый в избытке реагента, кислотах, но
не растворяется в аммиаке и NH4Cl.
|
Белый
осадок гидроксида олова, не растворимый в избытке реагента.
|
Серо-зеленый
или сине-фиолетовый осадок гидроксида хрома, растворяется в избытке реагента,
частично в аммиаке.
|
Сульфид-ионы
(Na2S)
|
Белый осадок
сульфида цинка ZnS, не растворимый в уксусной кислоте, но растворяется в
мининеральных кислотах.
|
Белый
осадок гидроксида алюминия.
|
Темно-коричневый
осадок SnS, нерастворимый в щелочах и избытке реагента
|
–
|
K4[Fe(CN)6]
(pH<7)
|
Белый
осадок – в нейтральной или слабокислой среде
|
–
|
–
|
–
|
Дитизон*
|
Комплекс
красного цвета, который экстрагируется из водной фазы в органическую
|
–
|
–
|
–
|
Ализарин*
|
–
|
В
аммиачной среде образуется малорастворимый комплекс ярко красного цвета
|
–
|
–
|
Алюминон*
|
В
уксуснокислой или аммиачной среде образуется комплекс красного цвета
|
|||
*8-оксихинолин
в
присутствии ацетата натрия
|
–
|
Зеленовато-желтый
кристаллический осадок, растворимый в минеральных кислотах
|
–
|
–
|
Окислители
– пероксид водорода в кислой среде
Пероксид
водорода в щелочной среде в присутствии экстрагента (амиловый спирт +
диэтиловый эфир)
|
–
|
–
|
–
|
Cr3+окисляется
доCrO42-появляется желтая окраска в щелочной среде; в
кислой среде оранжевая –Cr2O72-
Образуется
надхромовая кислота Н2CrO6, которая неустойчива в воде;
в присутствии экстрагента извлекается из воды и органический слой
окрашивается в интенсивно-синий цвет
|
Соли
висмута (III) + раствор щелочи
|
Черный
осадок металлического висмута
|
|||
Пламя
горелки
|
Синее
окрашивание
|
|||
Выводы:
Тема 32: Реакції катіонів V групи, групи реактивів.
Катіони 5 аналітичної групи утворюють атоми металічних (Mg, Mn, Fe) і амфотерних елементів (Sb) та елементів, у яких переважають металічні властивості (Bi). Для них властиві змінні стехіометрична валентність, ступінь окиснення і заряд йонів, за винятком Mg2+ ;реакції окиснення-відновлення; забарвлення їх йонів і сполук; здатність утворювати координаційні сполуки.
Катіони 5 аналітичної групи взаємодіють з лугами з утворенням гідроксидів, мало розчинних у воді та надлишку лугу, але добре розчинних у мінеральних кислотах (крім свіжо осадженого стибій гідроксиду , що розчиняється і в надлишку лугу).
Важливіші реакції виявлення.
1. Реакції йонів Fe2+.
1.1. О-фенантролін.
На смужку фільтрувального паперу поміщають краплю розчину солі феруму (ІІ), додають 2 краплі 0,2 М розчину хлоридної кислоти й краплю розчину фенантроліну. У присутності Fe2+ утворюється червона пляма.
1.2. K3[Fe(CN)6] - калій гексаціаноферат (ІІI).
У пробірку поміщають 4-5 краплини розчину солі феруму (ІІ), додають стільки ж дистильованої води і 3-4 краплі розчину K3[Fe(CN)6]. Спостерігають утворення синього кольору осаду “турнбулевої сині”.
3FeSO4 + 2K3[Fe(CN)6] = 3K2SO4 + Fe3[Fe(CN)6]2
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2
1.3. Диметилгліоксим (реактив Чугаєва).
На смужку фільтрувального паперу поміщають краплю солі феруму (ІІ), додають краплю розчину диметилгліоксиму і краплю розчину амоній гідроксиду . У присутності Fe2+ з’являється червона пляма.

2. Реакції йонів Fe3+.
2.1. K4[Fe(CN)6] - калію гексаціаноферат (ІІ).
У пробірку поміщають 4-5 краплин розчину солі феруму (ІІІ), додають стільки ж дистильованої води, 5-6 крапель розчину HCl і 3-4 краплі розчину K4[Fe(CN)6]. Спостерігають утворення синього кольору осаду “берлінської блакиті”.
4Fe(NO3)3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KNO3
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3
2.2. KSCN або NH4SCN - калій або амоній тіоціанат.
На смужку фільтрувального паперу поміщають краплю солі феруму (ІІІ), краплю розведеного розчину HCl і 2-3 краплі розчину калій або амоній тіоціанату . У присутності Fe3+ з’являється червона пляма.
Fe(NO3)3 + 3KSCN = Fe(SCN)3 + 3KNO3
Fe3+ + 3SCN- = Fe(SCN)3
3. Реакції йонів Mn2+.
3.1. Н2О2 – окислення гідроген пероксидом
У пробірку поміщають 1-2 краплини розчину солі мангану (ІІ), додають 4-5 краплин розчину HNO3, 5-7 краплин 3% розчину Н2О2 і нагрівають до кипіння. Спостерігають утворення осаду манганатної (IV) кислоти.
3.2. NaBiO3 – окислення натрій бісмутатом.
У пробірку поміщають 1-2 краплини розчину солі марганцю, додають 4-5 краплин розчину HNO3, перемішують і присипають невелику кількість NaBiO3. Спостерігають появу рожевого відтінку характерного для перманганат-іона.
4MnSO4 + 10NaBiO3 + 14H2SO4 = 4NaMnO4 + 5Bi2(SO4)3 + 3Na2SO4 + 14H2O
4Mn2+ + 10BiO3- + 28H+ = 4MnO4- + 10Bi3+ + 14H2O
4. Реакції йонів Bi3+.
4.1. Н2О (гідроліз солей бісмуту(ІІІ).
У пробірку поміщають 4-5 краплин розчину солі бісмуту(ІІІ) і приливають 8-10 мл дистильованої води. Спостерігають утворення білого осаду.
BiCl3 + H2O = BiOCl + 2HCl
4.2. KI - калій йодид.
На смужку фільтрувального паперу поміщають краплю солі бісмуту, додають краплю розчину KI і спостерігають утворення чорної зони, що відповідає сполуці BiI3, а також жовтого кільця (комплекс K[BiI4] ).
BiCl3 + KI = BiI3 ↓+ KCl
BiI3 + KI = K[BiI4]
19.3. SnCl2 – відновлення станум(ІІ) хлоридом.
SnCl2 + 4NaOH = Na2[Sn(OH)4] + 2NaCl
Bi(NO3)3 + 3NaOH = Bi(OH)3↓ + 3NaNO3
3Na2[Sn(OH)4] + 2Bi(OH)3 = 3Na2[Sn(OH)6] + 2Bi↓
У пробірку поміщають 2-3 краплі свіжоодержаного розчину станум(ІІ) хлориду, краплями додають міцний розчин натрій гідроксиду, поки осад, що утворився, повністю розчиниться в надлишку лугу. До одержаного розчину додають 1-2 краплі розчину солей бісмуту(ІІІ). Спостерігають утворення чорного кольору осаду металічного бісмуту.
5. Реакції йонів Mg2+.
5.1. Na2HPO4 - динатрій гідрогенфосфат.
У пробірку поміщають 4-5 краплин розчину солі магнію, додають по 1 краплі розчину амоній хлориду, 2-3 краплі розчину амоній гідроксиду і 4-5 крапель розчину Na2HPO4. Спостерігають утворення кристалічного осаду –магній – амоній фосфату білого кольору.
MgCl2 +Na2HPO4 +NH4OH = MgNH4PO4 +2NaCl+H2O
Mg2+ + HPO42- + NH4+ + OH- = MgNH4PO4+ H2O
MgCl2 +Na2HPO4 +NH4Cl = MgNH4PO4+ 2NaCl +HCl
Mg2+ + HPO42- + NH4+ = MgNH4PO4+ H+
5.2. C9H6NOH - 8-Оксихінолін.
У пробірку поміщають 4-5 краплин розчину солі магнію, додають 2 краплі розчину амоній гідроксиду , декілька крапель розчину амоніюй хлориду (до розчинення осаду Mg(OH)2 ) і додають 2-3 краплі розчину 8-оксихіноліну. Спостерігають утворення жовто-зеленого кристалічного осаду комплексної сполуки оксихінолінату магнію, який розчиняється в кислотах.
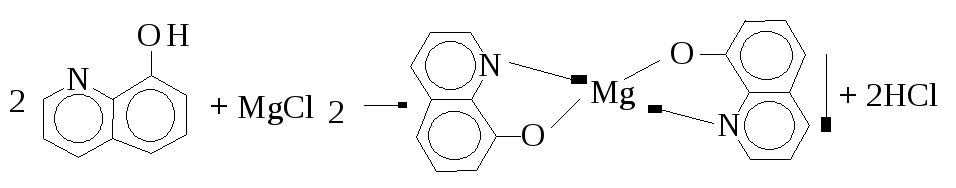
6. Реакції йонів Sb(ііі) і Sb(V).
6.1. Na2S2O3 - динатрій триоксотіосульфат .
У пробірку поміщають 4-5 краплин розчину солі стибію (ІІІ), додають 2-3 краплі розчину Na2S2O3. Спостерігають випадання оранжево-червоного осаду Sb2OS2 .
SbCl3 + 2Na2S2O3 + H2O = Sb2OS2 + 4NaCl + 2HCl
6.2. Залізні або алюмінієві ошурки, магній, цинк.
У пробірку поміщають 4-5 краплин розчину солі стибію (ІІІ) або стибію (V), додають 2-3 краплі концентрованої HCl, небагато залізних ошурок і нагрівають. Спостерігають виділення елементного стибію .
H3SbCl6 + Fe = FeCl3 + Sb + 3HCl
2H[SbCl6] + 5Mg = 5MgCl2 + 2Sb + 2HCl
6.3. Метиловий фіалковий.
У пробірку поміщають 4-5 краплин розчину солі стибію (V), додають 2-3 краплі концентрованої HCl, 2-3 краплі гідроген пероксиду 3%, перемішують ї злегка нагрівають. Краплю цього розчину переносять на фільтрувальний папір, додають краплю метиленового фіалкового. В присутності стибію (V) пляма забарвлюється у фіолетово-синій колір.
Оформити лабораторну роботу.
Зробіть разгорнуті висновки за дослідами.
Тема 32 - зробіть стислий конспект.
Надішлить фото-звіт лабораторної роботи та конспекту на Viber
за номером +380997066912
Комментарии
Отправить комментарий