Тема 29: Реакції катіонів IV групи, групи реактивів.
До четвертої аналітичної групи відносять катіони, здатні утворювати амфотерні гідроксиди. Для виявлення і розділення катіонів цієї групи широко використовують реакції утворення і розчинення осадів, одержання комплексних сполук, окиснення та відновлення.
Близькі електронна будова і радіус катіонів четвертої аналітичної групи обумовлює однакове їх відношення до сильних основних гідроксидів – лугів. Взаємодія катіонів четвертої аналітичної групи з надлишком лугу (NaOH чи KOH) є груповими реакціями. Продуктами цієї взаємодії є аніони Zn(OH)42-, Sn(OH)42-, Sn(OH)62-, Al(OH)63- , Cr(OH)63- .
Важливіші реакції виявлення.
1. Реакції йонів Zn2+.
1.1. NaOH, KOH – натрій чи калій гідроксиди.
У пробірку поміщають 4-5 краплин розчину солі цинку, додають 5-6 краплин розчину натрій гідроксиду. Спостерігають утворення білого осаду цинк гідроксиду , який має амфотерні властивості і тому розчиняється в кислотах і лугах.
ZnSO4 + 2NаОН= Zn(OH)2 + Nа2SO4
Zn(OH)2+ 2NаОН= Nа2[Zn(OH)4]
1.2. NH3∙Н2O – розчин амоніаку .
У пробірку поміщають 4-5 краплин розчину солі цинку, додають 5-6 краплин розчину NH3∙Н2O . Спостерігають утворення білого осаду цинк гідроксиду , який розчиняється в надлишку амоніаку з утворенням комплексної сполуки.
ZnSO4 + 2NH3 + 2H2O = Zn(OH)2 + (NH4)2SO4
Zn(OH)2 + 6NH3 = [Zn(NH3)6]2+ + 2OH-
1.3. K4[Fe(CN)6] – калій гексаціаноферат(ІІ).
У пробірку поміщають 4-5 краплин розчину солі цинку, додають стільки ж краплин розчину K4[Fe(CN)6]. Спостерігають утворення білого осаду K2Zn3[Fe(CN)6]2 , який не розчиняється в кислотах, а розчиняється в лугах з утворенням цинкату.
3ZnSO4 + 2K4[Fe(CN)6] = K2Zn3[Fe(CN)6]2 ↓+ 3K2SO4
1.4. Дитизон (дифенілтіокарбазон).
У пробірку поміщають 4-5 краплин розчину солі цинку, додають суміш рівних об’ємів розчину ацетатної кислоти й розчину натрій ацетату і 2-4 мл розчиненого в СНСl3 дитизону. Спостерігають утворення комплексної сполуки червоного кольору, яка добре розчиняється в хлороформі, бензені та інших органічних розчинниках.
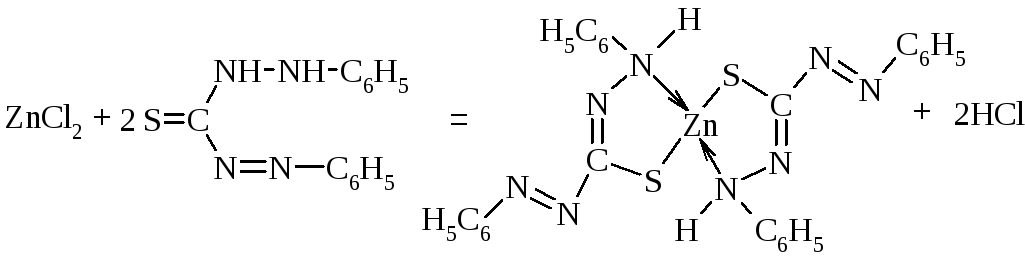
1.5. (NH4)2[Hg(SCN)4] - амоній тетрамеркурат (ІІ).
У пробірку поміщають 4-5 крапель розчину солі цинку, додають 2-3 краплі розчину солі (NH4)2[Hg(SCN)4] і спостерігають утворення білого осаду. Реакції заважають йони Cо2+ та Cu2+. В присутності Cu2+ в кислому середовищі утворюється осад оливковозеленого кольору, а присутності Cо2+ - темно-синього.
ZnSO4 + (NH4)2[Hg(SCN)4] = Zn[Hg(SCN)6] + (NH4)2SO4
Zn2+ + 2[Hg(SCN)4]2- + Cu2+ = Zn[Hg(SCN)6]•Cu[Hg(SCN)6]↓
2. Реакції йонів Al3+.
2.1. NaOH, KOH – натрій чи калій гідроксиди.
У пробірку поміщають 4-5 краплин розчину солі алюмінію, додають 5-6 краплин розчину натрій гідроксиду. Спостерігають утворення білого осаду алюміній гідроксиду , який має амфотерні властивості і тому розчиняється в кислотах і лугах.
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
Al3+ + 3OH- = Al(OH)3
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
2.2. NH3∙Н2O – розчин амоніаку.
У пробірку поміщають 4-5 краплин розчину солі алюмінію, додають 5-6 краплин розчину NH3∙Н2O . Спостерігають утворення білого осаду алюміній гідроксиду .
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + NH4Cl
2.3. Алізариновий червоний S.
У пробірку поміщають 4-5 краплин розчину солі алюмінію, додають розчин натрій гідроксид до сильно лужної реакції. Якщо випадає осад, його відокремлюють і до прозорого розчину додають 1-2 краплі розчину алізарину. Спочатку з’являється фіолетове забарвлення, потім додають краплями розчин ацетатної кислоти до зникнення фіолетового забарвлення. У присутності йонів алюмінію розчин забарвлюється в червоний колір.
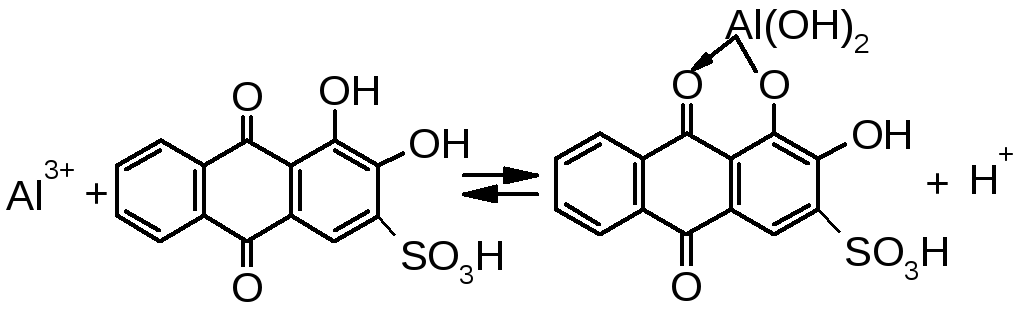
12.4. Алюмінон.
У пробірку поміщають 3-4 краплини розчину солі алюмінію, додають 2-3 краплі розчину ацетатної кислоти і 3-5 крапель розчину алюмінону. Нагрівають суміш на водяній бані, перемішують, додають розчин амоніаку до лужної реакції (проба на лакмус) і 2-3 краплі амоній карбонату . У присутності йонів алюмінію, залежно від концентрації, розчин забарвлюється в червоний колір або випадає червоний осад.
3. Реакції йонів Cr3+.
3.1 Н2О2 – окислення гідроген пероксидом .
У пробірку поміщають 4-5 краплин розчину солі хрому, додають розчин лугу (до розчинення осаду Cr(OH)3 ), 5-7 краплин 3% розчину Н2О2. Отриману суміш нагрівають і спостерігають утворення CrO42- жовтого кольору. Вміст пробірки охолоджують і додають розведену H2SO4 до переходу жовтого забарвлення в оранжеве. У другій пробірці готують суміш із рівних невеликих об’ємів розведеного розчину H2SO4, органічного розчинника (амілового спирту) і 3% розчину Н2О2. До отриманої суміші приливають розчин оранжевого кольору з першої пробірки і після енергійного струшування спостерігають синє забарвлення органічного шару, обумовлене утворенням надхромової кислоти.
Cr2(SO4)3 + 3H2O2 + 10NaOH = Na2CrO4 + 3Na2SO4 + H2O
Сr3+ + 2H2O2 + 4OH- = CrO42- + 4H2O
Na2Cr2O7 + 4H2O2 + H2SO4 = 2CrO5 + 5H2O + Na2SO4
CrO5 + H2O = H2CrO6 або H3CrO8 (H7CrO10)
Cr2O72- + 4H2O2 + 2H+ = 2CrO5 + 5H2O
3.2. KMnO4 – калій тетраоксоманганат.
У пробірку поміщають 4-5 краплин розчину солі хрому, додають 3-4 краплі 2 М розчину H2SO4, 3-4 краплі розчину калій тетраоксоманганату, суміш нагрівають. Спостерігають зміну кольорів.
2Сr(NO3)3 + 2KMnO4 + 5H2O = H2Cr2O7 + 2MnO(OH)2↓ + 2KNO3 + 4HNO3
2Cr3+ + 2MnO4- + 5H2O = Cr2O72- + 2MnO(OH)2↓ + 6H+
4. Реакції йонів Sn2+.
4.1. HgCl2 – меркурій (ІІ) хлорид.
У пробірку поміщають 4-5 краплини розчину солі стануму(ІІ), додають 1-2 краплі розчину HgCl2 . Спостерігають випадання чорного осаду Hg.
SnCl2 + 2HgCl2 = SnCl4 + Hg2Cl2
Hg2Cl2 + SnCl2 = SnCl4 + 2Hg
Sn2+ + 2Hg2+ + 2Cl- = Hg2Cl2 + Sn4+
Hg2Cl2 + Sn2+ = Sn4+ + 2Hg + 2Cl
4.2. Bi(NO3)3 – бісмут(ІІІ) нітрат.
У пробірку поміщають 4-5 краплин розчину солі стануму(ІІ), приливають надлишок NaOH і додають 1-2 краплі розчину Bi(NO3)3. Спостерігають випадання чорного осаду Bi.
3Na2SnO2 + 2Bi(NO3)3 + 6NaOH = 2Bi + 3Na2SnO3 + 6NaNO3 + 3H2O
5. Реакції йонів As3+.
5.1. AgNO3 – аргентум нітрат.
У пробірку поміщають 4-5 краплин розчину солі Na3AsO3, додають 2-3 краплі розчину AgNO3. Спостерігають випадання осаду Ag3AsO3.
Na3AsO3 + 3AgNO3 = Ag3AsO3 + 3NaNO3
AsO33- + 3Ag+ = Ag3AsO3
Тема 30:Схема аналізу суміші катіонів IV групи.
Систематичний хід аналізу суміші катіонів 4 аналітичної групи.
Хід аналізу катіонів четвертої групи складається з трьох стадій:
1) виявлення та відокремлення катіонів Al3+ , Sn(IV);
2) виявлення та відокремлення катіонів цинку;
3) виявлення та відокремлення катіонів Cr3+ і As3+.
До досліджуваного розчину (об’ємом близько 1 мл) додають 1 мл розчину амоніаку і стільки ж гідроген пероксиду. Суміш нагрівають на водяній бані. Утворений осад алюміній та стануму (1V) гідроксидів відокремлюють центрифугуванням. Осад розчиняють у хлоридній кислоті, розділяють на дві частини і характерними реакціями виявляють йони алюмінію і стануму.
Центрифугат, який може містити йони CrO42-, AsO43-, [Zn(NH3)4]2+ нейтралізують ацетатною кислотою, 2-3 хв. нагрівають на водяній бані і додають розчин натрій карбонату для осадження цинку. Осад основної солі Zn2(ОH)2СО3 відокремлюють і розчиняють у невеликій кількості ацетатної кислоти. Виявляють Zn2+ у добутому розчині за допомогою дитизону або (NH4)2[Hg(SCN)4].
Фільтрат після відокремлення основної солі Zn2(ОH)2СО3 може містити хромат- і арсенат-аніони. Хромат-аніони виявляють реакцією утворення надхромової кислоти H2CrO6, арсенат-аніон – відновленням до AsH3 .
[Al(OH)6]3-, [Zn(OH)4]2-, CrO42-, [Sn(OH)6]2-
 NH4Cl
NH4Cl

 Розчин: CrO42-, [Zn(NH3 )4]2+,
Осад: Al(OH)3, Sn(OH)4
Розчин: CrO42-, [Zn(NH3 )4]2+,
Осад: Al(OH)3, Sn(OH)4

 H2SO4, H2O2 Na2CO3 2M HCl
Синій розчин – надхромова кислота
Осад: Zn(OH)2CO3
Розчин: Al3+,[SnCl6]2-
H2SO4, H2O2 Na2CO3 2M HCl
Синій розчин – надхромова кислота
Осад: Zn(OH)2CO3
Розчин: Al3+,[SnCl6]2-

 Алізарин 2M NH3
2M HCl
Алізариновий лак червоного кольору
Безбарвні кристали (октаедри)Розчин: іони Zn2+
Алізарин 2M NH3
2M HCl
Алізариновий лак червоного кольору
Безбарвні кристали (октаедри)Розчин: іони Zn2+
 Дитизон
Бурувато-червоне забарвлення органічного шару
Дитизон
Бурувато-червоне забарвлення органічного шару
Вивчити лекційний матеріал. Зробіть стислий конспект.
Надішлить фото-звіт конспекту на Viber за номером +380997066912



Бурувато-червоне забарвлення органічного шару
Надішлить фото-звіт конспекту на Viber за номером +380997066912
Комментарии
Отправить комментарий